研究紹介
はじめに
私たちは一見安定した存在に見えますが、実は約2ヶ月で体のほとんどの部品は新しいものと入れ替わっています。これは生物に秘められたリサイクル活動です。また、ときには環境変化に応じて体の一部をより積極的に分解することもあります。つまり「日常的な地道な分解」と「激しく誘導される分解」を巧みに使い分けています。私たちはこのどちらにも関与する「オートファジー(自食作用)」と呼ばれる細胞内の大規模な分解系を対象に、生命体が変わらぬ健康状態を保ちつつ、大胆に変化することもできる秘密を研究しています。
タンパク質とは
生命の最小単位は細胞です。例えば大腸菌のような単細胞生物はひとつの細胞で生物として活動しています。一方、ヒトは数10兆個の細胞から出来ています。これらの細胞の中にはさまざまな生体分子(タンパク質、脂質、糖質、核酸など)があります。その中で、タンパク質はもっとも量が多く、ヒトでは2万種類以上のタンパク質が作られています。タンパク質は、細胞内の化学反応の触媒、信号伝達、物質輸送などのさまざまな働きをしています。これこそが生命活動の基本なのです。したがって、私たちは生きるために、毎日毎日大量のタンパク質を合成しています。
タンパク質とは、20種類のアミノ酸がいろいろな順番でつながったものです。このアミノ酸の並び方でタンパク質の役割がきまります(この並び順こそがみなさんの遺伝子に書かれていることなのです)。ここで大切なことは、私たちの体のタンパク質はヒト固有のものですが、アミノ酸はすべての生物で共通して使われているということです。私たちの使っているアミノ酸と大腸菌の使っているアミノ酸は基本的に同じ種類です。なので、私たちはアミノ酸を一から作る必要はなく(そうすることもできます)、他の生物が作ったタンパク質を食べてアミノ酸に分解すれば、それをそのまま使うことができます。
タンパク質の合成と分解のバランス
しかし、成人が1日に食べるタンパク質は約60-80gにすぎず、一方で体の中では1日に160-200gものタンパク質が合成されています。これはどういうことでしょうか? 実は食事だけではなく、私たち自身のタンパク質も分解されてリサイクルされているのです(図1)。つまりタンパク質の材料のほとんどは食事ではなく、自分自身の分解産物ということになります。「タンパク質分解は食事より重要である」といっても言い過ぎではありません。私たち人間社会も一度作ったものをいかに上手くリサイクルするかが問題になっていますが、生体内ではすでにきちんと行われているわけです(もっと効率が良く、しかも計画的ですが!)。
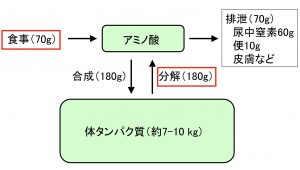
タンパク質を分解する方法
タンパク質のリサイクル活動は細胞の外よりも細胞の中でとても活発です。細胞のなかには大きく分けると二つの分解系に分類することができます。
選択的タンパク質分解系
どのタンパク質を分解するべきかをきちんと見定めてから分解する方法です。例えば、「ユビキチン」という印のついたタンパク質をせっせと分解する「プロテアソーム」が代表です。 温泉にたとえれば、たまったゴミを一つずつ捨てるようなものです(図2)。実際の温泉では大変ですが、細胞内ではうまく機能しています。
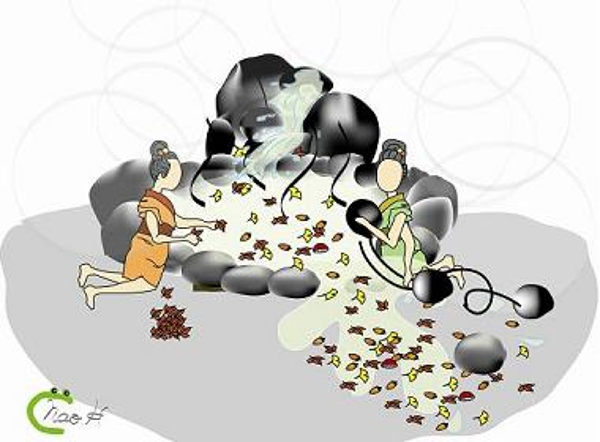
ユビキチン・プロテアソーム系はゴミを個別に認識する(左)。一方、オートファジーは基本的には個別な識別をせずに、ゴミとともに湯も捨て、新しい湯を入れることで新鮮さを保つ(右)。一見無駄に思える方法でも、効率はよいと考えられる(画・細川奈生(OG))
主に非選択的なバルク分解系
こちらは、なんでも分解できる万能システムです。しかし、このようなものがその辺にあっては危険で仕方ありません。そこでこのような強力な酵素は細胞内の「リソソーム」と呼ばれる小さな袋(細胞内小器官)にしまわれています。細胞は必要な量だけ、自身の一部をリソソームに運んで分解しています。その主要な方法が図に示す「オートファジー(自食作用)」です(図3)。分解するものをいちいち見分けずにまとめて分解するため、バルク分解と呼ばれています(バルクとは「かさの大きい、大規模な」という意味です)。温泉ではこのような一見いい加減な方法でお湯の新鮮さを保っています。しかし、後述するように、オートファジーも相手をある程度認識していることがわかってきてきます。
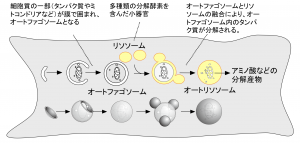
細胞質の一部が膜によって取り囲まれ、細胞内成分を含んだオートファゴソームが形成される。次にオートファゴソームと分解酵素を含んだリソソームが融合(合体)することによってオートファゴソームの中身が分解される。
オートファジー研究の意義
私たちの研究室では、この一見乱暴で大雑把に見えるオートファジーの仕組みと役割について研究しています。最初に述べましたように、オートファジーの役割は、日常的に静かにおこっている「基底レベル」のオートファジーと、ある状況下で激しくおこる「誘導されるオートファジー」のふたつに分けるのが考えやすいと思います。
基底レベルのオートファジー ~細胞の健康をたもつ~
細胞内のタンパク質は新鮮さを保つために常に入れ替わっています。基底レベルのオートファジーはその重要な担い手であると考えられています。これは温泉のお湯をいつもきれいにしておくために、一定の割合でいつもお湯をいれながらこぼすのと似ています。一見無駄なようにも見えますが、案外効率のよい方法です。また、細胞内に侵入した細菌や不良化したミトコンドリアなどは特別に識別されて、オートファジーで分解されることもわかってきました。この基底レベルのオートファジーが上手く働かないと、細胞内にゴミがたまってきます。例えば、私たちが作製した神経細胞でオートファジーをおこせないマウスは、神経細胞内に異常なタンパク質が蓄積し、神経変性疾患を発症しました(より詳しい解説へ)。ハンチントン舞踏病、パーキンソン病、筋萎縮性側索硬化症(ALS)などのヒトの病気も細胞内に異常なタンパク質がたまることが特徴のひとつなので、オートファジーはこのような変性疾患をおこさないようにしている可能性もあります。実際、ヒトの神経変性疾患のひとつ(SENDA病)では、オートファジー遺伝子の変異がみつかっています(より詳しい解説へ)。
また、オートファジーによる細胞の品質管理は、発がん予防にも重要であると考えられています。私たちはオートファジーの抗腫瘍効果を動物実験で初めて示すことにも成功しました(より詳しい解説へ)。最近ではオートファジーの活性化と長寿との関係も指摘されています。
誘導されるオートファジー ~飢餓などの変化に対応する~
オートファジーは栄養飢餓時に特に激しくおこります。食事から栄養がとれないとき、細胞は自身の一部を過剰に分解してそれを栄養素としているようです。マウスではたった一晩の絶食によって全身でオートファジーが顕著におこります。また、哺乳類の新生児は生まれると同時に飢餓に瀕しますが、そのような時もオートファジーをおこして生きのびていることを私たちは明らかにしました(より詳しい解説へ)。
さらに私たちは受精直後の胚(受精卵)でもオートファジーが活性化することを発見しました(より詳しい解説へ)。着床までの間に必要な栄養を胚(受精卵)が自らを分解して作り出しているのだろうと考えています。魚や卵よりははるかに少ないものの、哺乳類の卵にも栄養が備わっていて、オートファジーによってそれを利用しているようです。
飢餓時や受精後におこるオートファジーによって作られたアミノ酸は、そのとき必要なタンパク質の合成に主に利用されていると考えられていますが、まだ十分には調べられていません。
当研究室の研究テーマ
当研究室ではオートファジーの基礎的研究に取り組んでおり、具体的には次のような課題の研究を行っています。
- オートファジーのメカニズムを分子レベルで調べる
- 生体内でのオートファジーの生理的役割を調べる
- オートファジーの活性測定方法を開発する
- オートファジーの病態形成における関与を明らかにする

